Als enllaços
covalents, els electrons que participen en l'enllaç estan compartits, és a dir,
estan sota la influència de dos nuclis. És obvi que quan els dos àtoms son
iguals (com a les molècules de Cl2 o O2) els electrons es
comparteixen de forma igualitària i la densitat electrònica de la molècula és
simètrica.
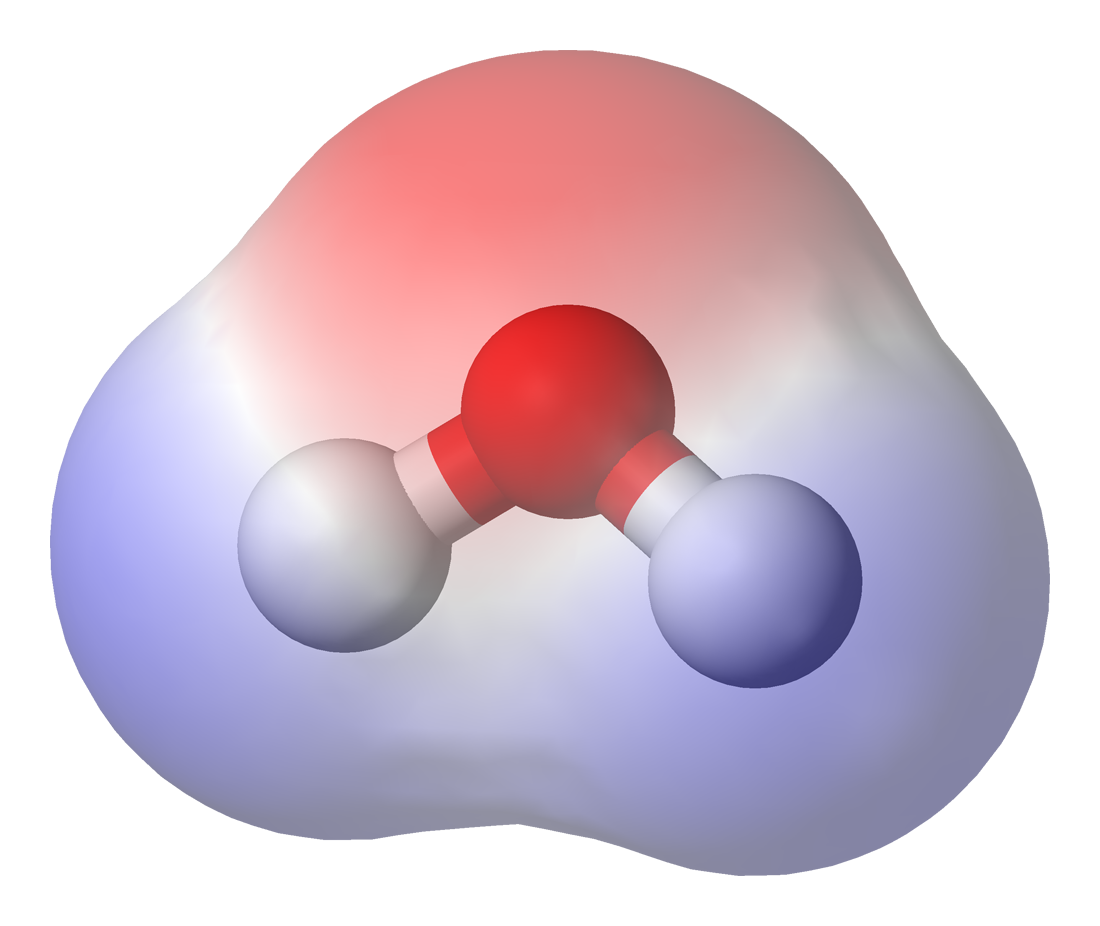
 |
| Diagrama de densitat electrònica d'un enllaç covalent simètric (font) |
Però, què passa
quan els dos àtoms són distints i la seva afinitat electrònica és diferent?
Doncs els electrons són atrets més fortament pel nucli del àtom més
electronegatiu, de forma que la densitat electrònica serà major al voltant
d'aquest nucli.
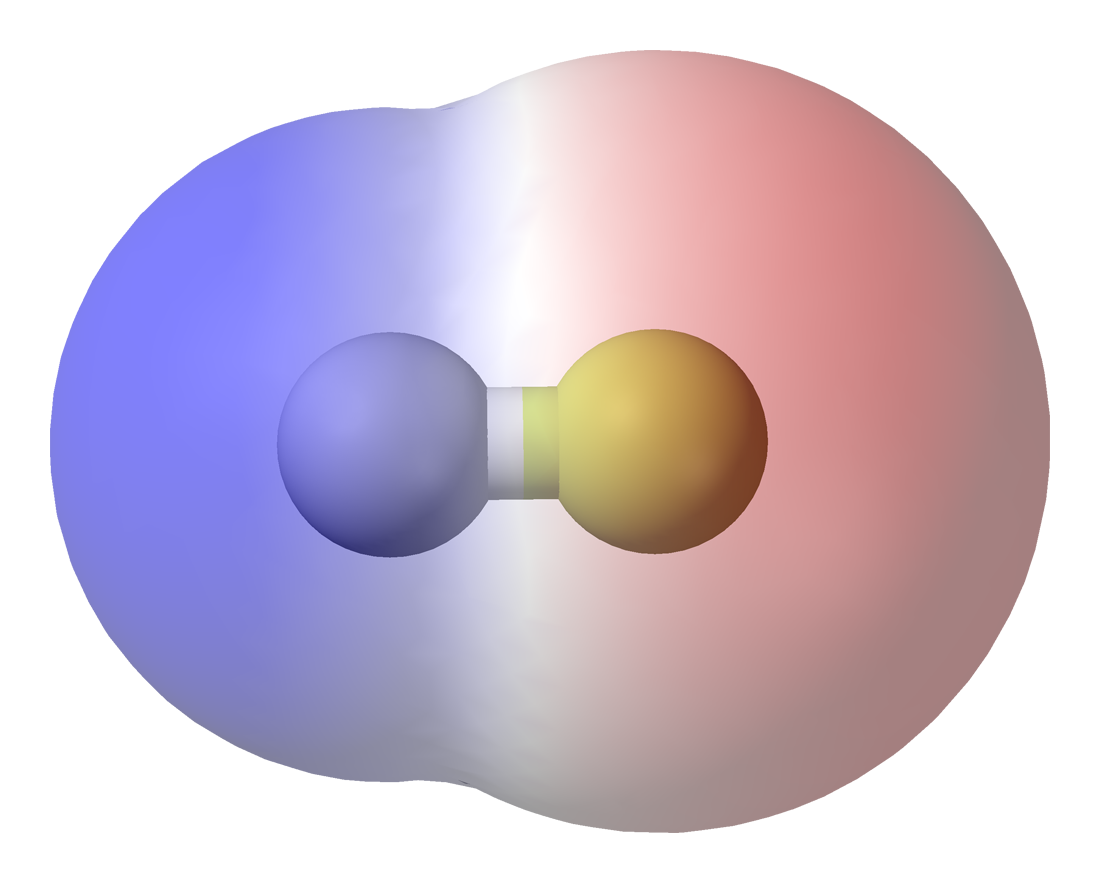 |
| Diagrama de densitat electrònica dún enllaç covalent polar (HF, font) |
La distribució
desigual d'electrons en una molècula d'aquest tipus fa que apareixen càrregues
parcials. No estem parlant d'una càrrega pròpiament dita, sinó d'una manca o
excés de càrrega menut en parts de la molècula.
La densitat
electrònica no simètrica d'aquests enllaços proporciona polaritat a la
molècula. La polaritat permet interaccions electrostàtiques febles que fan que
les propietats de substàncies polars siguen diferents de les no polars (per
exemple, tenen major punt de fusió per aquestes interaccions). Quan major és la
diferència en electronegativitat dels àtoms, aquestes característiques
s'aproximen a les de les substàncies iòniques. Existeix una gradació entre
enllaç iònic i covalent, de manera que s'ha establert un límit, més o menys
arbitrari, per determinar si un enllaç és d'un tipus o de l'altre. Aquest límit
ve donat pel percentatge de caràcter iònic de l'enllaç (80%) o per diferencia
d'electronegativitat dels àtoms constituents (2,5).
Cal tenir en
compte que si una molècula té més d'un enllaç polar, es poden orientar de manera que la polaritat total de la molècula siga nul·la.
 |
| La geometria lineal del CO2 i tetraèdrica del CH4 anul·la la polaritat molecular, encara que els enllaços individuals són polars (font) |