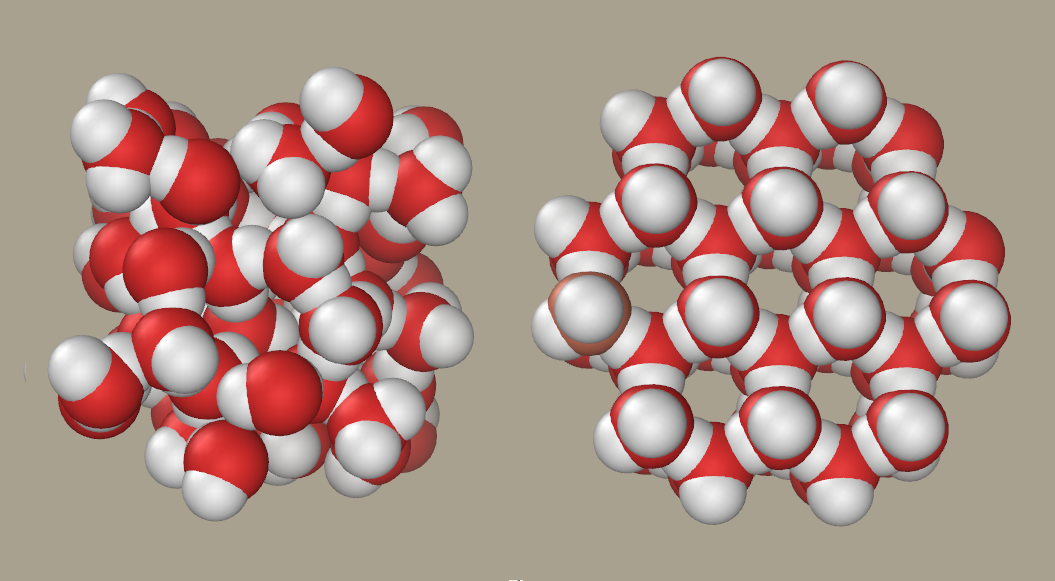
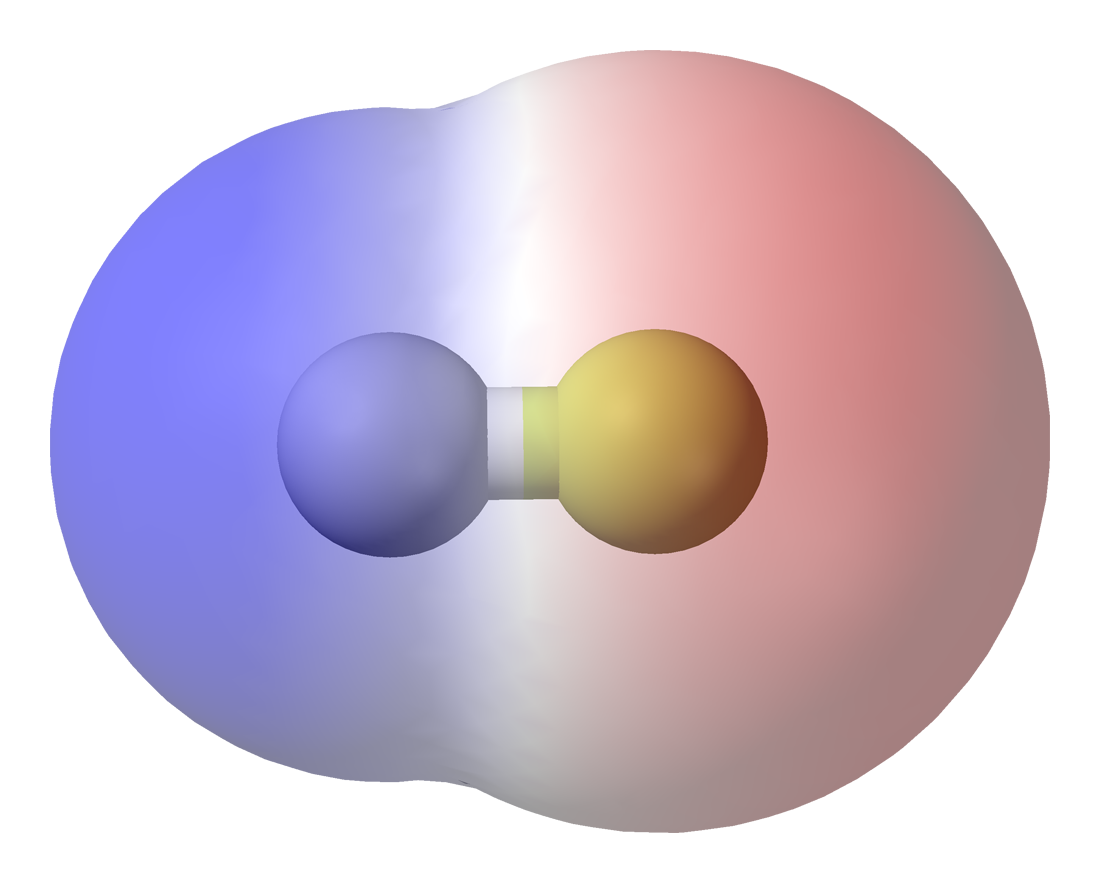
Existeixen una
gran varietat de compostos químics amb diferents propietats, estructures i
estabilitats. Fins ara, sols hem vist molècules més o menys simples, però hi ha
moltíssimes molècules de gran complexitat.
Dins d'aquestes
molècules es troben els compostos orgànics o biomolècules, que son aquells
basats en el carboni. Parlarem de la química del carboni en una futura unitat,
però és interesant estudiar alguna d'aquestes molècules des del punt de vista
de l'enllaç químic.
Sense anar-nos-en
a macromolècules com l'ADN o proteïnes, podem veure part de la seua
complexitat. Per exemple, si observem un àcid gras, veurem que té una cadena
llarga formada per enllaços C-C i C-H, sense polaritat e insoluble en aigua.
Quan observem l'extrem àcid de la molècula apareixen enllaços C-O i O-H que
presenten una elevada polaritat i que, fins i tot, poden ionitzar-se i formar
sals iòniques.
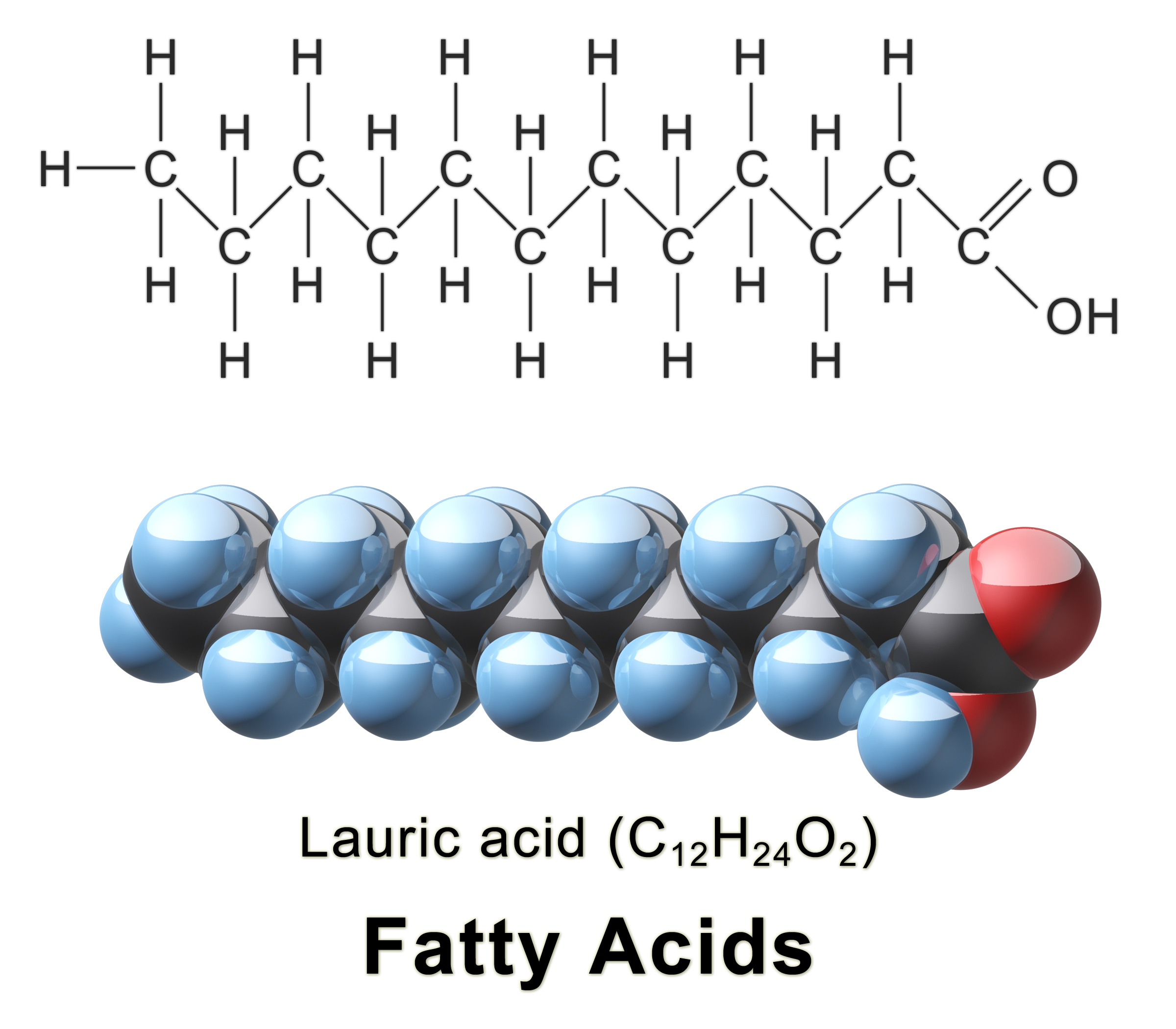 |
| Estructura de l'àcid gras lauric (fatty acid en anglés, font) |
Sense aprofundir
massa en aquest punt, està clar que es fàcil analitzar un únic enllaç aïllat i
dir tipus i propietats. Però quan trobem molècules amb desenes, centenars, o
tal volta, millars d'enllaços, es requereix un estudi més complex per
determinar la naturalesa de les mateixes. A més a més, les molècules poden
presentar comportaments distints depenent de l'entorn al que les someten.



.jpg)