Pot ser ja sabeu
que el diamant i el grafit tenen la mateixa composició: ambdues són formes al·lotròpiques
de carboni. Probablement també coneixeu les diferències obvies: el grafit s'usa
per escriure i el diamant en joies. Però sabeu quines són les diferencies a
nivell atòmic?
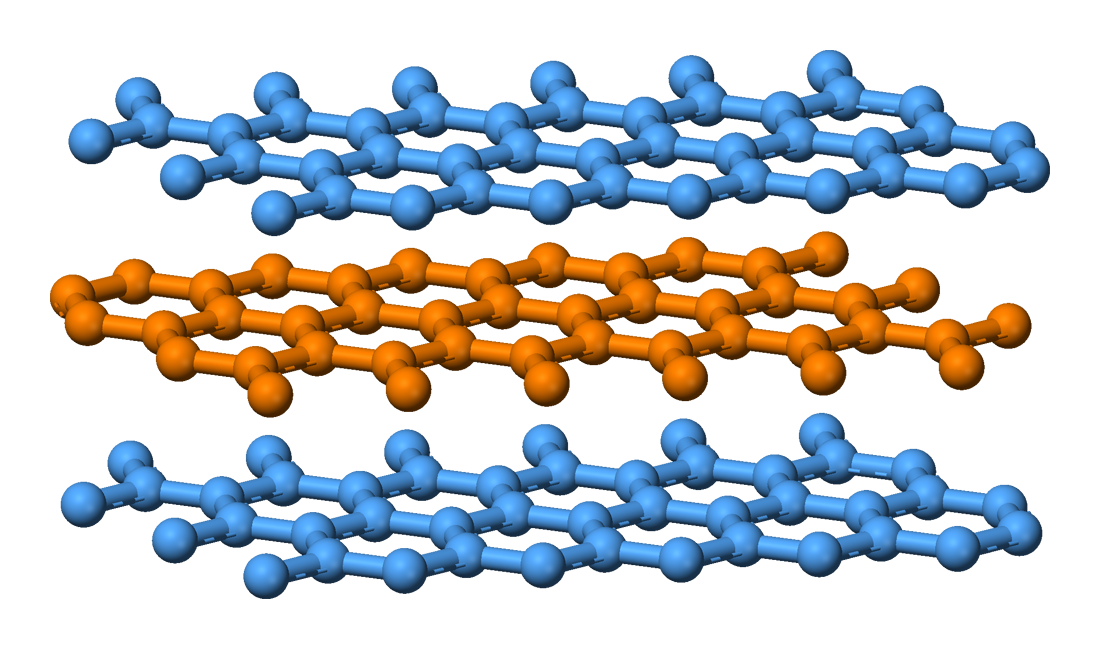
El grafit està
format per una estructura laminar en la que els àtoms es distribueixen de forma
hexagonal. Cada àtom de carboni està enllaçant amb 3 àtoms formant un triangle. Aquesta
estructura fa que el material es puga dividir en làmines i, per això, és un bon
material per a escriure. A més a més, la disposició dels orbitals atòmics del
carboni en el grafit permet la mobilitat electrònica i, per tant, la
conductivitat elèctrica.
 |
| Estructura laminar del grafit (font) |
El diamant
cristal·litza formant xarxes tridimensionals d'àtoms de carboni en un sistema
cúbic. Cada àtom de carboni està enllaçant amb quatre àtoms que formen els
vèrtexs d'un tetraedre. Aquesta és una estructura molt estable i fa que el
diamant siga el mineral més dur que existeix en la naturalesa (nivell 10 a
l'escala de Mohs). L'estabilitat també és patent en altres característiques ja
que el diamant és insoluble, inert i no condueix electricitat.
 |
| Animació que mostra la xarxa cúbica del diamant (font) |
Cap comentari:
Publica un comentari a l'entrada