Els estats de la
matèria (sòlid, líquid i gas) es diferencien a nivell molecular en el grau
d'ordenació de les seues partícules així com en el moviment de les mateixes. En
general, si observem com les molècules es comporten, aquestes perden mobilitat
i guanyen ordre segons van de gas a líquid i de líquid a sòlid. Aquest major
ordre fa que la densitat també augmente. Per què, doncs, el gel (sòlid) és
menys dens que l'aigua (líquida) i flota sobre aquesta?
Les molècules
d'aigua (H2O) interaccionen de manera diferent ja que els seus àtoms
presenten característiques excepcionals. L'àtom d’hidrogen té una peculiaritat,
i és que únicament posseeix un electró; aleshores, quan forma un enllaç i aquest
es comparteix, el nucli queda d'alguna manera descobert, deixant una càrrega
positiva accessible per a interaccionar amb electrons. Al mateix temps, els
àtoms d'oxigen tenen parells d'electrons no enllaçants que poden interactuar
amb el nucli d'hidrogen.
 |
| Representació d'una molècula d'aigua que mostra l'absència d'electrons en els àtoms d'hidrogen i la presència de parells no enllaçants en l'àtom d'oxigen (font) |
Aquestes dues
característiques fan que siga possible la formació de l’anomenat enllaç (o
pont) d'hidrogen. Encara que aquesta interacció no siga formalment un enllaç,
té característiques que fa que es comporte com a tal. El pont d'hidrogen
presenta una distància i una energia determinada, però més feble que les d'un
enllaç. Aquestes propietats fan que, quan l'aigua comença a solidificar-se, les
molècules s'ordenen d'una manera característica que deixa alguns espais buits,
i la densitat, en comptes d'augmentar, disminueix.
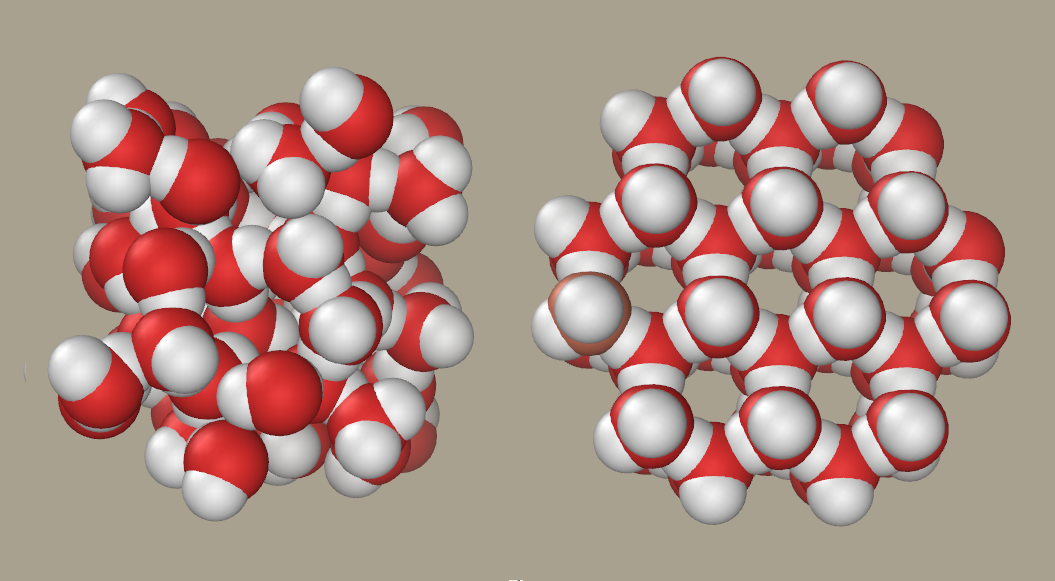 |
| Representació de la distribució de les molècules d'aigua líquida (esquerra) i sólida (dreta) on es pot observar com l'ordenació de les molècules deixa espais buits fent que la densitat siga menor (font) |
Cap comentari:
Publica un comentari a l'entrada